|
- Dwutlenek siarki SO2, tlenki azotu NxOy, węglowodory CxHy, pyły
(zawierające m.in. izotopy promieniotwórcze i metale ciężkie) częściowo osadzają się na powierzchni ziemi, część ich rozpuszcza się w kroplach chmur (wody) i tworzy kwasy i wraz z deszczem lub śniegiem opada jako tzw.
kwaśny opad.
- Stopień zanieczyszczeń powietrza określa się mierząc koncentrację tlenku siarki(IV) SO2
- W Polsce aż w 56 okręgach miejsko - przemysłowych wielokrotnie przekraczane są dopuszczalne normy zanieczyszczeń
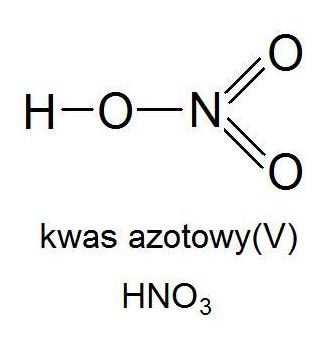
- Jedną z przyczyn zanieczyszczeń powietrza jest powstawanie w atmosferze kwasu azotowego(V). Tlenek azotu(II), tworzący
się głównie w procesach spalania, przekształca się potem w kwas azotowy(V), który to wpływa niekorzystnie na klimat - przyczynia się do
przyspieszenia globalnego ocieplenia i powiększa dziurę ozonową. Jest on utleniany przez O2 lub O3 :
NO + O3 --> NO2 + O2.
Następnie ditlenek azotu utleniany jest przez rodniki hydroksylowe (najbardziej reaktywna forma tlenu, posiadająca
niesparowany elektron). Reakcja ta przebiega następująco :
NO2 + OH + M --> HNO3 + M przy czym M jest jakimś
trzecim ciałem. Ponieważ w tej reakcji jako substraty występują częściowo produkty procesów fotochemicznych, zachodzi ona głównie w czasie dnia. Kwas azotowy(V) usuwany
jest z atmosfery zarówno w postaci mokrego jak i suchego opadu atmosferycznego i jest on jednym z głównych czynników zwiększających ich kwasowość. W pewnym stopniu reaguje
on z amoniakiem, którego głównym źródłem są nawozy azotowe. Równanie reakcji usuwania HNO3 z atmosfery wygląda
następująco : NH3 + HNO3 --> NH4NO3
Wzór strukturalny kwasu azotowego(V). Źródło:www.chemfiztip.blogspot.com
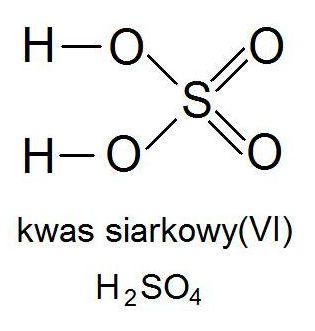
- Kwas siarkowy(VI) także zanieczyszcza atmosferę, a proces jego tworzenia jest bardziej złożony niż tworzenie się HNO3. Siarkowodór (sulfan), disiarczek węgla,
siarczek karbonylu - to tylko kilka substancji zawierających siarkę na najniższym (II) stopniu utlenienia. Po przedostaniu się tych związków do atmosfery rozpoczyna się ciąg
reakcji ich utleniania. Wymienione substancje ulegają utlenieniu przez rodniki hydroksylowe, w wyniku czego powstają rodniki sulfanylowe jako produkt początkowy. Reakcje te
to:
H2S + OH --> H2O + SH
CS2 + OH --> COS + SH
COS + OH --> CO2 +SH
Spośród tych trzech połączeń siarkowodór i disiarczek
węgla reagują szybko, natomiast siarczek karbonylu, uwalniany bezpośrednio z wód oceanicznych lub powstającyw wyniku utleniania disiarczku węgla, jest kinetycznie względnie
trwały w reakcji utleniania. Dalsze utlenianie rodnika sulfanylowego prowadzi do powstania ditlenku siarki:
SH + O2 --> SO + OH
SH + O3 ---> SHO + O2
SHO + O2 --> SO + HOO
SO + O3 --> SO2 + inne produkty
Tworzenie się kwasu siarkowego(VI) z ditlenku siarki zachodzi w wyniku co najmniej dwóch różnych grup procesów. Pierwsza z nich to sekwencja reakcji homogenicznych w
fazie gazowej, którą rozpoczyna reakcja:
SO2 + OH + M --> HOSO2 + M
Rodnik HOSO2 ulega licznym i względnie szybkim reakcjom prowadzącym do powstania kwasu siarkowego(VI). Najprostszym i najważniejszym procesem,
w którym tworzy się kwas, jest:
HOSO2 + O2 + M --> HOO + SO3 + M
Z kolei w wyniku rozpuszczania się tritlenku siarki w wodzie tworzy się właściwy kwas siarkowy(VI):
SO3 + H2O --> H2SO4
Wzór strukturalny kwasu siarkowego(VI). Źródło:www.chemfiztip.blogspot.com
- Jony, które wpływają na stopień zakwaszenia opadów to jony amonowe i oksoniowe. Ponieważ jon amonowy jest bardzo słabym kwasem(pH = 9,25) w obecności nawet niewielkiego
nadmiaru jonów oksoniowych nie może dstarczać protonów i jego wpływ na pH opadu atmosferycznego jest nie do pominięcia. Jednak, gdy jony amonowe znajdą się
w glebie lub w wodzie w warunkach aeoroboowych, w wyniku mikrobiologicznego utlenienia powstają jony azotanowe(V) i dwa jony oksoniowe z każdego jonu amonowego:
NH4+ + 2 O2 + H2O --> NO3-(aq) + 2 H3O+(aq).
W ten pośredni sposób jony amonowe mają znaczący udział w zakwaszaniu opadów atmosferycznych.
- W ostanim czasie opracowano proces do ograniczania emisji kwasowych składników gazowych uwalnianych przez elektrownie, o nazwie SONOX. Proces ten zaczęto wykorzystywać
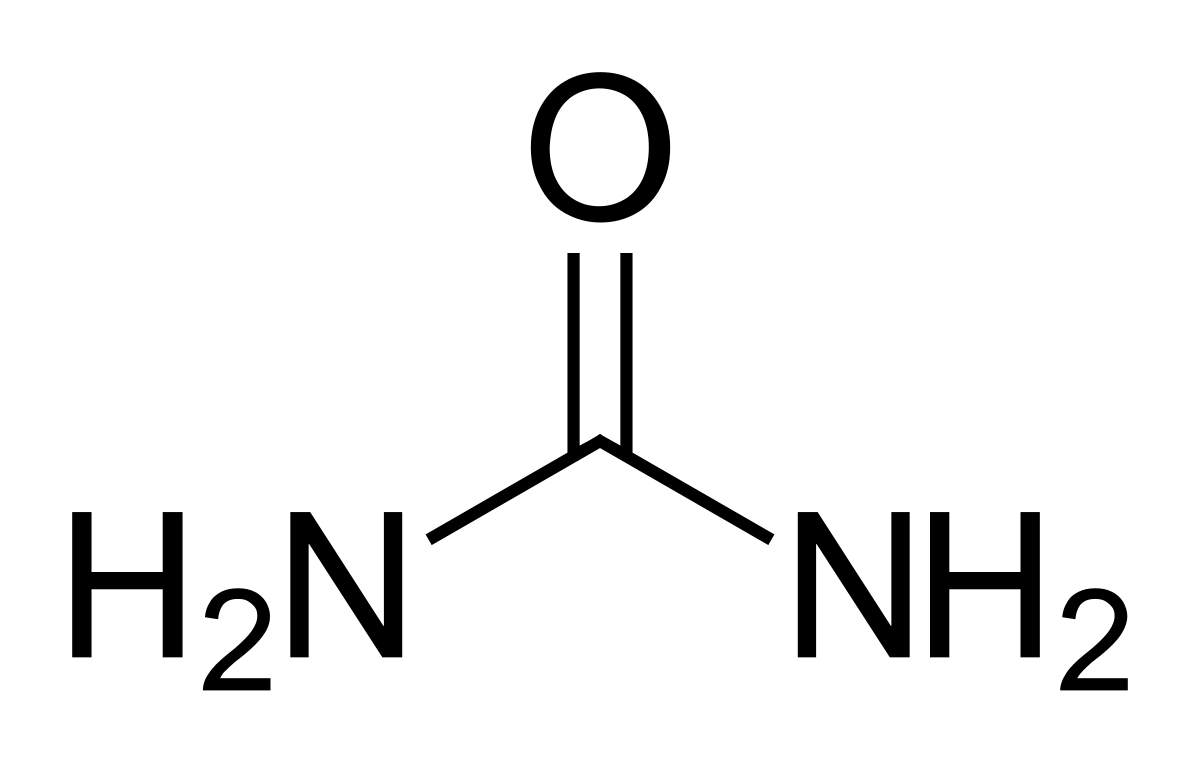
w Kanadzie (firma Ontario Hydro) w niewielkim urządzeniu badawczym. Proces polega na wdmuchiwaniu do pieca wodnej zawiesiny zawierającej sorbenty wapniowe, zazwyczaj
sproszkowany kamień wapienny, dodatki zawierające azot, zazwyczaj mocznik, w temperaturze między 900 i 1350C. W gorącej atmosferze pieca zachodzą następujące reakcje:
CACO3 (s) --> CAO(s) + CO2 (g)
CAO(s) + SO2 (g) + 1/2 O2 (g) --> CASO4 (s)
NH2CONH2 (s) + 2 NO (g) + 1/2 O2 (g) --> 2 N2 (g) + CO2 (g) + 2 H2O
Wzór strukturalny mocznika. Źródło:www.biotechnologia.pl
|
|